ملف خاص عن فاقدي البصر
العين في الذكاء الاصطناعي
كما ذكرنا ، فإن Seeing AI من Microsoft هو تطبيق مصمم لمساعدة الأشخاص ضعاف البصر أو المكفوفين. إنه يعزز العالم حول المستخدم بأوصاف صوتية غنية. يمكنه قراءة ملاحظة مكتوبة بخط اليد أو مسح رمز شريطي ضوئيًا ثم إخبار المستخدم بالمنتج. وجه الكاميرا إلى شيء ما وسيصف التطبيق عدد الأشخاص الذين يمكنهم رؤيتهم ومكان وجودهم في الصورة - في المنتصف وأعلى اليسار وما إلى ذلك.
خرائط صوتية ثلاثية الأبعاد
بالنسبة للشخص المبصر ، يمكن أن يعني المشي على طول الشارع استيعاب كل التفاصيل التي تحيط به. يكرر Microsoft Soundscape هذا السلوك من خلال إنشاء خريطة صوتية مفصلة تربط ما يحدث حول شخص يعاني من إعاقة بصرية ، ويخلق طبقات من السياق والتفاصيل من خلال الاعتماد على بيانات الموقع ومنارات الصوت وصوت ستيريو ثلاثي الأبعاد مركب لبناء تحديث مستمر خريطة صوتية ثلاثية الأبعاد للعالم المحيط.
المعرفة في متناول يدك
تم استخدام طريقة برايل لما يقرب من 200 عام طريقة لمس للقراءة بأطراف الأصابع. لقد انتقل الآن من الصفحة إلى الشاشة بالإصدار المحدث من الراوي ، قارئ الشاشة لنظام التشغيل Microsoft Windows ، الذي يدعم شاشات برايل الرقمية ولوحات المفاتيح. خارج جهود Microsoft ، أثبتت شاشات اللمس بطريقة برايل التي تعمل بنفس الطريقة التي تعمل بها الأجهزة اللوحية شعبيتها بين الطلاب والمعلمين. في مؤتمر جمعية صناعة التكنولوجيا المساعدة لعام 2019 في أورلاندو ، فلوريدا ، تضمنت الابتكارات المعروضة BraiBook ، وهو قارئ إلكتروني بطريقة برايل يلائم راحة اليد ، وحتى لعبة إلكترونية تسمى Braille Buzz ، مصممة لتعليم طريقة برايل لمرحلة ما قبل المدرسة. .
منارات التغيير
تعمل إشارات البلوتوث ، مثل تلك التي تستخدمها شركة Foresight Augmented Reality ، كإرشادات دقيقة للغاية وشخصية للأشخاص المكفوفين أو ضعاف البصر. في حين أن تقنية GPS الأساسية يمكن أن تنقل المستخدمين إلى موقع ما ، فإن الإشارات المثبتة في متجر أو مطعم أو مبنى عام يمكن أن توجههم إلى مدخل المبنى المعني. وعندما يكون المستخدم بالداخل ، يمكن للمنارات الأخرى توجيههم إلى الحمام أو إلى مرافق مهمة أخرى.
سيارة كهربائية
لا يخاطر الاتحاد الأوروبي بأمان الناس. يعني التشريع الجديد أن السيارات الكهربائية يجب أن تكون مسموعة عند السرعات المنخفضة وأثناء الرجوع للخلف. تقوم بعض الشركات المصنعة بالفعل بدمج الضوضاء الاصطناعية في سياراتهم الكهربائية.
النظارات الذكية
يعمل باحثون في جامعة عجمان في الإمارات العربية المتحدة على تطوير مجموعة من النظارات الذكية التي يمكنها استخدام الذكاء الاصطناعي للقراءة وتوفير معلومات التنقل وربما التعرف على الوجوه. تتصل النظارات بهاتف ذكي من خلال وحدة معالجة ، مما يسمح للنظام بالعمل دون اتصال بالإنترنت ، ولا تزال هذه النظارات الذكية في المراحل الأولى من التطوير ، ولكن يُقال إنها تعمل بمعدل دقة قراءة يبلغ 95٪.
الذكاء الاصطناعي لإمكانية الوصول
تم إطلاق برنامج Microsoft
AI for Accessibility
العام الماضي ، مع التزام بقيمة 25 مليون دولار لوضع تكنولوجيا Microsoft
في أيدي الشركات الناشئة والمطورين والباحثين والمنظمات غير الربحية من أجل دفع
الابتكار وتضخيم القدرات البشرية للأشخاص ذوي الإعاقة. يبحث البرنامج باستمرار عن
مشاريع جديدة لدعمها.
https://news.microsoft.com/on-the-issues/2019/08/08/smart-tech-blind-low-vision/
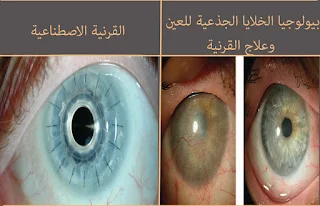
حيدر أباد: تنظم جامعة شيفيلد بالمملكة المتحدة ومعهد إل في براساد للعيون بالهند ورشة عمل لمدة أربعة أيام من 20 إلى 23 أبريل 2017 في حيدر أباد لمناقشة الحلول العلمية المبتكرة لعلاج القرنيات التالفة ، وهي جزء من العين ضروري للبصر ورشة العمل هذه بعنوان "تطبيق الكيمياء المبتكرة والمواد الحيوية لعلاج القرنية المتضررة من الصدمات والمرض والعدوى" هي جزء من برنامج روابط باحث نيوتن-بهابها ، والذي يهدف إلى الجمع بين الباحثين البريطانيين ونظرائهم في الهند ، لتبادل الأفكار وحلها. المشاكل العالمية للسنة الثانية على التوالي ، تستثمر الجمعية الملكية للكيمياء ، بالاشتراك مع المجلس الثقافي البريطاني من خلال صندوق نيوتن ، 2.5 كرور روبية هندية ، لتقديم تسع ورش عمل في Newton Researcher Links ، لتزويد الباحثين الهنود والمملكة المتحدة بفرصة التعلم من بعضنا البعض وبناء تعاون بحثي طويل الأمد ومستدام.
يعاني ما يصل إلى 10 ملايين شخص في الهند من العمى - كثير منهم بسبب مشاكل في القرنية. القرنية السليمة شفافة ، لكن العدوى أو الصدمات أو الاضطرابات الوراثية يمكن أن تسبب ضررًا ، مما يؤدي إلى فقدان البصر جزئيًا أو كليًا. يمكن للعدوى البكتيرية والفطرية أيضًا أن تلحق الضرر بالقرنية ، مما يؤدي إلى تقرح القرنية وغالبًا ما يؤدي إلى فقدان العين بأكملها. تعد العدوى البكتيرية على وجه الخصوص مشكلة متنامية ، بسبب زيادة المقاومة للمضادات الحيوية ، وستتاح الفرصة لكل من العلماء في بداية حياتهم المهنية لتقديم أبحاثهم ، وسيحضر كبار العلماء كموجهين لقيادة المناقشات وتقديم التوجيه.
يوضح ستيفن هوثورن ، نائب الرئيس التنفيذي للجمعية الملكية للكيمياء
المندوبون هم في الغالب علماء في بداية حياتهم المهنية ولديهم خبرة في إما الكيمياء أو المواد الحيوية ، من كل من الهند والمملكة المتحدة. تم اختيارهم من بين مجموعة كبيرة وتنافسية من التطبيقات. "هذه فرصة مثيرة للخبراء الشباب ، من خلفيات متنوعة وبأفكار جديدة ، للالتقاء والتركيز على المشكلات السريرية العملية لعمى القرنية.من خلال ورشة العمل ، نأمل في إقامة علاقات تعاون جديدة بين المملكة المتحدة والهند ، ورعاية جيل جديد من العلماء الشباب القادرين على الاستجابة لهذه الحاجة السريرية الملحة. "
قالت مي-كوي باركر ، مديرة المجلس الثقافي البريطاني بجنوب الهند: "إن الانتشار العالمي للمجلس الثقافي البريطاني والتزامه ببناء علاقات دولية قوية يتيحان لنا دعم العلوم بشكل أفضل. من خلال صندوق نيوتن بهابها ، سنستخدم نقاط القوة في المملكة المتحدة في البحث والابتكار لدعم قدرة أكبر على البحث العلمي في الهند وبناء شراكات بحثية بين المؤسسات البحثية البريطانية والهند. على مر السنين ، قمنا بدعم أكثر من 250 باحثًا مهنيًا مبكرًا وسندعم 300 باحث آخر هذا العام. نأمل أن تساهم المهارات والمعرفة التي تم تطويرها من خلال هذه الشراكة مساهمة كبيرة في مختلف المجالات التي يقوم عليها العلم ".
اقتباس من معهد إل في براساد للعيون - د. أخبر فيفيك سينغ (عالم) أن تركيزنا ينصب على تجديد العين ، وطرق ووسائل القيام بذلك باستخدام جميع أساليب العلوم والتكنولوجيا المتاحة ، وابتكار حلول جديدة حيثما أمكن ذلك. الهدف الرئيسي هو القضاء على عمى القرنية. قد يشمل ذلك (أ) بيولوجيا الخلايا الجذعية للعين وعلاج القرنية ، (ب) استبدال الخلايا والأنسجة باستخدام مواد متوافقة حيوياً (القرنية الاصطناعية) ، (ج) استكشاف الطباعة ثلاثية الأبعاد للأنسجة وأجزاء الأعضاء مثل القرنية باستخدام الخلايا أو حتى باستخدام مفهوم القرنية السائلة لإغلاق عيوب انسجة القرنية. التزامنا طويل الأمد لمحاولة معالجة مشكلة عمى القرنية ، التي تؤثر على الملايين في جميع أنحاء العالم. "
اقتباس من الأستاذة شيلا ماكنيل بجامعة شيفيلد - "كان العمل في شراكة مع الزملاء في LVPrasad ملهمًا حقًا. إنه لشرف كبير أن أكون قادرًا على العمل مع مبتكرين إكلينيكيين من الطراز العالمي لمعالجة المشاكل السريرية للرؤية والتي يمكن أن تترجم إلى علاج محسن للمرضى الذين يعانون من فقدان البصر بسبب مشاكل القرنية "
ستشارك المؤسسات الرائدة في المملكة المتحدة مثل جامعة إدنبرة وكلية لندن الجامعية وجامعة مانشستر وجامعة وارويك مع معاهد البحوث الهندية الرائدة مثل IISER-Kolkata و ICT-Mumbai و IIT Delhi و IIT-Kanpur و JNCASR-Bangalore لإجراء ورش عمل حول الطاقة النظيفة ومقاومة مضادات الميكروبات (AMR) والمواد النانوية والتقنيات الخضراء في عام 2017.
في عام 2016 ، دعمت
الجمعية الملكية للكيمياء والمجلس الثقافي البريطاني ست ورش عمل لنيوتن ، بتنسيق
من جامعة رائدة مثل كامبريدج ونوتنجهام و IIT دلهي و IIT Madras
و IIT Mandi. تداول أكثر من 250 عالمًا من كل من المملكة المتحدة والهند
وتبادلوا أبحاثهم حول القضايا المتعلقة بالتحديات العالمية مثل المياه ومقاومة
مضادات الميكروبات والاستدامة والطاقة.
https://www.britishcouncil.in/about/press/finding-innovative-solutions-treat-blindness
عيون الكترونية
منذ ما يقرب من 30 عامًا ، بدأ مارك همايون ، مهندس الطب الحيوي بجامعة جنوب كاليفورنيا في لوس أنجلوس ، في تحفيز شبكية العين كهربائيًا للأشخاص المصابين بالعمى. من خلال العمل مع زملائه في شركة Second Sight Medical Products ، وهي شركة تكنولوجيا طبية في سيلمار ، كاليفورنيا ، أظهرت تجاربه أن مثل هذا التحفيز يمكن أن يحفز الإدراك البصري لبقع الضوء المسماة الفوسفين. بعد عقد من العمل على الحيوانات لتحديد مقدار التيار الكهربائي الذي يمكن تطبيقه بأمان على العين ، ومسلحًا بمعرفة متزايدة بشكل كبير حول عدد وأنواع الخلايا التي تستمر في تدهور شبكية العين البشرية ، كان فريق همايون جاهزًا لبدء العمل مع الناس. بين عامي 2002 و 2004 ، زرع الباحثون عينًا آلية في كل من ستة أشخاص مصابين بعمى كلي أو شبه كلي في عين واحدة - وهي التجربة الأولى من نوعها. أفاد متلقو الجهاز ، المعروف باسم Argus I ، أنهم قادرون على إدراك الفوسفين والحركة الاتجاهية وحتى الأشكال 2. يعيش الآن حوالي 300 شخص العالم من خلال خليفة هذا الجهاز ، Argus II ، والذي تمت الموافقة عليه من قبل المنظمين في أوروبا في عام 2011 لاستخدامه في الأشخاص المصابين بالتهاب الشبكية الصباغي - وهي مجموعة من الاضطرابات الوراثية النادرة التي تتسبب في تدهور الخلايا المستقبلة للضوء. حذت إدارة الغذاء والدواء الأمريكية (FDA) حذوها بعد ذلك بعامين
لتزويد المريض بأرجوس 2 ، يخضع لعملية جراحية لتوصيل شريحة تحتوي على مجموعة إلكترود بسطح الشبكية. "لرؤية" مع الجهاز ، تقوم كاميرا فيديو مصغرة مثبتة على زوج من النظارات بترحيل الإشارات إلى وحدة المعالجة التي يرتديها المستلم. يقوم المعالج بتحويل الإشارات إلى تعليمات يتم إرسالها لاسلكيًا إلى الجهاز المزروع. ثم تحفز الأقطاب الكهربائية الخلايا العقدية في الجزء الأمامي من الشبكية. يعد استخدام الطرف الاصطناعي عملية تعليمية. يجب على المستلمين تدريب عقولهم على تفسير النوع الجديد من المعلومات التي يتم تلقيها. ولأن كاميرا الفيديو لا تتبع حركة العين ، يجب عليهم أيضًا تعلم تحريك رؤوسهم لتوجيه نظرهم.
يوفر الجهاز رؤية محدودة فقط. يمكن للمستخدمين اكتشاف مصادر الضوء والأشياء ذات الحواف عالية التباين ، مثل الأبواب أو النوافذ ، ويمكن للبعض الآخر فك رموز الأحرف الكبيرة. تنشأ هذه القيود جزئيًا لأن 60 قطبًا كهربائيًا للجهاز توفر دقة منخفضة جدًا مقارنة بملايين الخلايا المستقبلة للضوء في العين السليمة. ولكن حتى هذا الحد الأدنى من التحسين يمكن أن يحسن حياة الناس إلى حد كبير.
في حين أن Argus II عبارة عن غرسة فوق الشبكية - بمعنى أنها تقع على سطح شبكية العين - فقد تم تصميم الأجهزة الأخرى قيد التطوير لتوضع تحت الشبكية. يمكن أن تحفز هذه الغرسات تحت الشبكية الخلايا الأقرب إلى تلك التي تقدم عادةً إشارات إلى شبكية العين - الخلايا المستقبلة للضوء. من خلال تحفيز الخلايا في أعلى المسار البصري ، يأمل الباحثون في الحفاظ على المزيد من معالجة الإشارات التي تقوم بها شبكية العين السليمة.
قامت شركة Retina Implant ، وهي شركة للتكنولوجيا الحيوية مقرها في Reutlingen ، بألمانيا ، ببناء غرسة تحت الشبكية تشتمل على صمامات ضوئية (أجهزة شبه موصلة تحول الضوء إلى تيار كهربائي) تستشعر الضوء الذي يدخل العين مباشرة. هذا يلغي الحاجة إلى كاميرا فيديو خارجية ، مما يتيح للمستخدمين توجيه نظرهم بشكل طبيعي. يتم توفير الطاقة من خلال وحدة محمولة باليد ، من خلال ملف يتم زرعه تحت الجلد فوق الأذن. حصل Alpha AMS ، الإصدار الحالي من النظام ، على الموافقة التنظيمية في أوروبا لاستخدامه في الأشخاص المصابين بالتهاب الشبكية الصباغي.
تختبر شركة Pixium Vision في باريس غرسة تحت الشبكية الكهروضوئية تسمى Prima. يقوم النظام بإصدار إشارات من كاميرا فيديو مثبتة على نظارات في العين باستخدام ضوء الأشعة تحت الحمراء القريبة ، والتي يقود طولها الموجي بشكل مثالي الصمامات الثنائية الضوئية في الجهاز لتحفيز خلايا الشبكية. يتيح عرض الصور بهذه الطريقة للمستخدمين بعض التحكم في اتجاه نظرهم ، لأنهم يستطيعون استكشاف المشهد من خلال تحريك أعينهم فقط. يتم توفير الطاقة أيضًا عن طريق ضوء الأشعة تحت الحمراء القريب ، مما يجعل الزرع لاسلكيًا والجراحة لتناسبها أقل تعقيدًا. يقول José-Alain Sahel ، طبيب العيون في جامعة Pittsburgh ، بنسلفانيا ، الذي يجري تجارب أمان للجهاز على عشرة أشخاص مصابين بـ AMD: "يتعلم المرضى كيفية استعادة الرؤية بشكل أسرع ، ويبدو الحل أفضل". "إنها الأيام الأولى ، لكن هذا واعد للغاية."
كل هذه الأجهزة تعمل فقط عندما تبقى الخلايا العاملة في شبكية العين. في حالات العين الشائعة التي تؤثر بشكل رئيسي على الخلايا المستقبلة للضوء ، بما في ذلك التهاب الشبكية الصباغي و AMD ، عادة ما يكون هناك بعض الخلايا المتبقية للتحفيز. ولكن عندما تموت عدد كبير جدًا من الخلايا العقدية في الشبكية ، كما يحدث في اعتلال الشبكية السكري المتقدم والزرق ، فإن مثل هذه الغرسات لا يمكن أن تساعد. بالنسبة للأشخاص الذين ليس لديهم أي وظيفة شبكية متبقية ، سواء بسبب المرض أو الإصابة ، قد يكون النهج الإلكتروني البديل أكثر ملاءمة.
يعمل همايون وزملاؤه على نظام يتجاوز العين بإرسال إشارات مباشرة إلى الدماغ. الفكرة ليست جديدة: ففي سبعينيات القرن الماضي ، أظهر مهندس الطب الحيوي الأمريكي ويليام دوبيل أن التحفيز المباشر للقشرة البصرية أدى إلى إدراك مادة الفوسفين 3. لكن تقنية العين الإلكترونية تلحق بالركب الآن فقط. قامت شركة Second Sight بتطوير Orion ، وهو نظام ، وفقًا لهمايون ، "في الأساس نظام Argus II المعدل". على غرار النسخة الأصلية ، تستخدم الكاميرا كاميرا فيديو ومعالج إشارة يتواصلان لاسلكيًا مع الغرسة ، لكن الرقاقة توضع على سطح القشرة البصرية بدلاً من شبكية العين. يتم اختبار الجهاز على خمسة أشخاص لديهم إدراك محدود أو معدوم للضوء بسبب إصابة في العين أو تلف في شبكية العين أو العصب البصري. يقول: "حتى الآن ، النتائج جيدة". "لم نفاجأ بأي شيء حتى الآن."
بالنظر إلى أن بعض التكنولوجيا قد تم تجربتها واختبارها بالفعل على الأشخاص ، فإن همايون متفائل بأن النظام يمكن أن يحصل على الموافقة التنظيمية في غضون بضع سنوات. "من الواضح أن جراحة الدماغ لها مستوى مختلف من المخاطر ، لكن الإجراء بسيط جدًا ، ويمكن أن يساعد أوريون الكثير من المرضى ،" كما يقول. ومع ذلك ، لا يُعرف الكثير عن تحفيز الدماغ لتوفير رؤية مفيدة. يقول بوتوند روسكا ، اختصاصي البيولوجيا العصبية في معهد طب العيون الجزيئي والإكلينيكي بازل في سويسرا: "نحن نعرف الكثير عن شبكية العين ولكن القليل جدًا عن القشرة المخية". يقول: "لكننا لن نعرف ما يكفي إذا لم نحاول".
العلاج الجيني
العين هدف مثالي للعلاج الجيني. نظرًا لكونها قائمة بذاتها نسبيًا ، فإن الفيروسات التي تستخدم لنقل الجينات إلى خلايا شبكية العين لا ينبغي أن تكون قادرة على الانتقال إلى أجزاء أخرى من الجسم. ونظرًا لأن العين موقع يتمتع بامتيازات مناعية ، فمن غير المرجح أن يقوم الجهاز المناعي بالدفاع ضد مثل هذا الفيروس.
شرع الباحثون في معالجة شكل محدد من الحالة يُعرف باسم LCA 2. يحدث هذا بسبب طفرات في RPE65 ، وهو الجين الذي يتم التعبير عنه بواسطة RPE. يؤثر الجين المتحول سلبًا على وظيفة RPE ، والتي بدورها تدمر الخلايا المستقبلة للضوء. في عام 2008 ، أظهرت الفرق الثلاثة ، بما في ذلك فريق بقيادة Hauswirth ، في تجارب إكلينيكية في مراحل مبكرة أن توصيل نسخة صحية من RPE65 إلى شبكية العين كان آمنًا وأدى إلى تحسينات محدودة في الرؤية. أظهرت تجربة سريرية من المرحلة الثالثة بقيادة ألبرت ماجواير ، طبيب عيون في جامعة بنسلفانيا في فيلادلفيا ، في أغسطس 2017 أن الأشخاص الذين يعانون من LCA 2 والذين تلقوا العلاج كانوا أكثر قدرة على التنقل في دورات عقبة على مستويات مختلفة من الإضاءة من أولئك الذين لم يفعلوا ذلك. . في ديسمبر 2017 ، وافقت إدارة الغذاء والدواء على العلاج ، voretigene neparvovec (Luxturna) ، مما يجعله أول علاج جيني لأي حالة يحصل على الضوء الأخضر للاستخدام السريري.
من الممكن علاج LCA 2 بهذه الطريقة لأن الطفرات الجينية المعنية تظهر نمطًا متنحيًا للوراثة. وهذا يعني أنه يجب أن تحمل كلتا نسختين من RPE65 الطفرات ذات الصلة لإحداث الاضطراب. لذا فإن توفير نسخة واحدة غير مطفرة يؤدي إلى حل المشكلة. ومع ذلك ، فإن الحالات التي تسببها الطفرات الوراثية السائدة لا تتطلب سوى نسخة واحدة متحولة من الجين لتظهر. في معظم هذه الحالات ، فإن مجرد إضافة نسخة طبيعية من الجين لن يساعد ؛ بدلاً من ذلك ، يجب تعطيل الجين المتحور. يتمثل أحد الخيارات في إسكاته عن طريق إضافة جزيئات معينة من الحمض النووي الريبي (RNA) التي تعترض تعليمات الجين المتحور لصنع البروتين المعيب ، ثم توفير نسخة طبيعية من الجين لتولي مهامه - وهو نهج يُطلق عليه الكبت والاستبدال. آخر هو تصحيح الطفرة باستخدام تقنية تحرير الجينات CRISPR-Cas9. أظهر الباحثون في جامعة مودينا وريجيو إميليا في مودينا بإيطاليا ، هذا النهج في نموذج فأر لالتهاب الشبكية الصباغي 8 في عام 2016. وفي العام التالي ، استخدمه فريق في الولايات المتحدة لتصحيح الطفرة التي تسبب نوعًا من الجلوكوما على حد سواء في الفئران وفي الخلايا البشرية المستزرعة 9.
كان أحد المحركات المهمة لتقدم العلاج الجيني هو استخدام الفيروس المرتبط بالغدية (AAV) لتوصيل الجينات البديلة إلى الخلايا. ثبت أن AAVs آمنة ، جزئيًا ، لأنها تميل إلى عدم الاندماج في جينوم الخلية المضيفة ، مما يقلل من خطر تحول الخلايا إلى خلايا سرطانية. وصغر حجمها يمكّنها من الانتشار على نطاق واسع عبر العين وبالتالي تصيب عددًا كبيرًا من الخلايا. لكن قدرة AAVs على إيصال الجينات لها حدود: فبعض الجينات ببساطة أكبر من أن تحملها AAVs ، بما في ذلك ABCA4 ، الطفرات التي يمكن أن تؤدي إلى مرض Stargardt ، وهو شكل وراثي من الضمور البقعي. يتم اتباع حلين. الأول يستخدم فيروساً ذا قدرة تحمل أكبر ، مثل الفيروس البطيء ، لتوصيل جينات بديلة. سلامة وفعالية هذا النهج غير معروفة ولكن التجارب السريرية جارية. تتمثل الإستراتيجية الثانية في تقسيم الجين البديل إلى قسمين ونقل كل نصف على حدة إلى الخلية ، جنبًا إلى جنب مع وسيلة لإعادة اتحادهم. يقول هاوسفيرث: "هذا يعمل في نموذج حيواني واحد على الأقل في الوقت الحالي".
بغض النظر عن النهج ، فإن العلاج الجيني له حدود كبيرة. هناك أكثر من 250 جينًا متورطًا في الإصابة بالعمى ، ولأن كل منها يمكن أن يتأثر بأنواع عديدة من الطفرات ، فإن عدد الأهداف العلاجية المحتملة هائل. على سبيل المثال ، تؤدي أكثر من 100 طفرة في الجين RHO إلى التهاب الشبكية الصباغي ، وهو اضطراب الشبكية الوراثي الأكثر شيوعًا. يقول هاوسفيرث إن تطوير العلاج الجيني لكل طفرة ليس عمليًا.
يعمل الباحثون على حل محتمل يُحدث تغييرًا في نهج القمع والاستبدال. بدلاً من استهداف نسخ RHO التي تحتوي على طفرة معينة ، يستخدمون RNA كاتمًا لقمع كل تعبيرات الجين ، سواء كان RHO متحورًا أم لا ، أثناء تقديم نسخة بديلة تكون محصنة ضد RNA الصامت. أظهر فريق بقيادة جين فارار ، عالمة الوراثة في كلية ترينيتي في دبلن ، وعدًا بهذه الاستراتيجية في عام 2011 في نموذج فأر مصاب بالتهاب الشبكية الصباغي السائد. في عام 2018 ، اختبر Hauswirth وزملاؤه هذا النهج على الكلاب المصابة بالتهاب الشبكية الصباغي 11. أظهروا أن تنكس الخلايا المستقبلة للضوء في المناطق المعالجة من شبكية العين يمكن إيقافه - وهو تحسن استمر لمدة ثمانية أشهر على الأقل. تعالج هذه الاستراتيجية جميع الطفرات التي يمكن أن تسبب التهاب الشبكية الصباغي الموروث بشكل سائد في a s
يعمل العلاج الجيني فقط مع الأشخاص الذين يحدث العمى بسبب طفرة جينية. كما أنه غير مناسب لمعالجة مرض الشبكية في المرحلة النهائية ، حيث لا يزال هناك عدد غير كافٍ من الخلايا التي يتعين إصلاحها. لكن النهج ذي الصلة الذي يعتمد على تقنية تسمى علم البصريات الوراثي هو حيادي للاضطراب ويمكن أن يؤدي إلى علاجات لمراحل مختلفة من الانحطاط. في علم البصريات الوراثي ، يتم توصيل الجينات التي تمكّن الخلايا من إنتاج بروتينات حساسة للضوء تُعرف باسم الأوبسين بواسطة فيروس. يمكن أن يؤدي إدخال opsins إلى استعادة بعض حساسية الضوء لمستقبلات الضوء التالفة ، أو حتى جعل خلايا أخرى في شبكية العين ، بما في ذلك الخلايا ثنائية القطب أو الخلايا العقدية الشبكية ، حساسة للضوء.
لكن المشكلة ، في حين أن الخلايا المستقبلة للضوء في العين يمكن أن تتعامل مع مجموعة واسعة من شدة الضوء - تعمل بشكل جيد في كل من ضوء الشمس الساطع والشفق - فإن opsins لها نطاق محدود وغالبًا ما تؤدي بشكل أفضل في شدة الضوء العالية. الحل المحتمل هو استخدام إعداد يعمل بطريقة مشابهة لنظام بريما للعين الإلكترونية من Pixium Vision ، حيث يتم تزويد المستلمين بنظارات تتضمن كاميرا فيديو تلتقط رؤية المستخدم وجهاز عرض يشير إلى أعينهم. . كما هو الحال مع Prima ، فإن الفائدة هي أن طبيعة الضوء الذي يدخل العين يمكن تكييفها مع تعديل شبكية العين ؛ ومع ذلك ، في هذه الحالة ، تكون الكثافة والطول الموجي المختاران هما الأفضل لدفع الأوبسين الذي تم إدخاله حديثًا بدلاً من الثنائيات الضوئية المزروعة.
تقوم شركة GenSight Biologics ، وهي شركة للتكنولوجيا الحيوية في باريس تعد الساحل و Roska من بين مؤسسيها ، باختبار مثل هذا النظام بالفعل. يهدف إلى توصيل opsin إلى خلايا العقدة الشبكية ، ولكن هناك عقبة محتملة: خلايا العقدة الشبكية حساسة بشكل طبيعي للضوء. يعبرون عن الميلانوبسين ، وهو بروتين يشارك في منعكس الحدقة ، حيث ينقبض تلميذ العين استجابة للضوء الساطع. لتجنب إثارة هذا ، يستخدم الباحثون في GenSight opsin الذي يستجيب للأطوال الموجية الحمراء للضوء ، لأن الميلانوبسين يستجيب بشكل تفضيلي للضوء في الطرف الأزرق من الطيف. بدأت الشركة تجربة إكلينيكية في مرحلة مبكرة في أكتوبر 2018 على الأشخاص المصابين بالتهاب الشبكية الصباغي المتقدم والذين لديهم أدنى قدر ممكن من الرؤية. ستشمل التجربة أفواجًا من المملكة المتحدة وفرنسا والولايات المتحدة ، ومن المتوقع أن تظهر النتائج الأولية بحلول نهاية عام 2020
تقول روسكا: "هذا نهج بسيط ، وعلينا أن نرى ما الذي سنكتسبه". "بعد ذلك ، يمكننا الانتقال إلى أساليب أكثر وأكثر تعقيدًا." إحدى المشكلات المتبقية هي أن العديد من الاضطرابات التي قد تعالجها تقنيات علم البصريات الوراثي تنطوي على انحطاط أجزاء معينة من الشبكية ، مع الاحتفاظ بالرؤية المفيدة في مناطق أخرى. الضوء الذي يدفع opsins مرئي ويمكن أن يتداخل مع الرؤية الطبيعية المتبقية. في المستقبل ، قد تعمل الأوبسين التي تستجيب لضوء الأشعة تحت الحمراء القريبة على تمكين علاجات علم البصريات الوراثي للعمل جنبًا إلى جنب مع الرؤية الطبيعية المتبقية.
تجديد الخلايا
يمكن أن يعالج العلاج بالخلايا الجذعية العمى حتى في المراحل المتأخرة من المرض. نظرًا لأنه يمكن إقناع الخلايا الجذعية بأن تصبح أي نوع من الخلايا ، فيمكن استخدامها لتنمية خلايا شبكية جديدة لزرعها في العين لتحل محل الخلايا المفقودة. ومع ذلك ، فقد أظهرت الدراسات التي أجريت على الحيوانات أن نسبة صغيرة فقط من الخلايا العصبية المزروعة قادرة على الاندماج بشكل صحيح في الدوائر العصبية المعقدة في شبكية العين. هذه عقبة كبيرة أمام علاجات الخلايا الجذعية التي تهدف إلى استبدال الخلايا العصبية في شبكية العين.
من ناحية أخرى ، فإن الخلايا التي تشكل ظهارة الشبكية الصبغية تقع خارج دائرة شبكية العين. وبالتالي ، فإن العلاجات القائمة على الخلايا الجذعية تبشر بالخير بالنسبة لبعض الحالات ، مثل AMD والتهاب الشبكية الصباغي ، التي تتسبب في تدهور خلايا RPE. يقول روسكا: "يجب أن تتصل المستقبلات الضوئية بالدائرة ، لكن ظهارة الشبكية الصباغية لا تفعل ذلك". "هذا هو المكان الذي يكون فيه الناس أقرب إلى تحقيق التقدم." في البداية ، حاول الباحثون حقن شبكية العين بخلايا RPE المشتقة من الخلايا الجذعية في حالة تعليق ، لكن القليل منهم عالق في المكان المطلوب. تعتقد العديد من الفرق الآن أن النهج الأفضل هو زرع خلايا RPE في العين كصفائح مُشكلة مسبقًا يتم تثبيتها بعد ذلك في موضعها بواسطة سقالة متوافقة حيوياً. "نهج السقالة هو تحسن كبير ، مقارنة بالتعليق ، لخلايا RPE ،" يقول سهل.
في مارس 2018 ، أعلن مشروع لندن لعلاج العمى - وهو تعاون بين كلية لندن الجامعية ومستشفى مورفيلدز للعيون في لندن - عن نتائج تجربة المرحلة الأولى التي تم فيها زرع ورقة من خلايا RPE في شبكية العين لشخصين مصابين بـ AMD الرطب. (شكل نادر وخطير من AMD يتضمن نموًا غير طبيعي وتسرب الأوعية الدموية). تحمل كلا المستلمين الإجراء جيدًا وكانا قادرين على قراءة 21-29 حرفًا على مخطط القراءة أكثر مما كان عليه قبل العلاج 12. في الشهر التالي ، أبلغ فريق بقيادة همايون عن نتائج مماثلة في المرحلة الأولى لخمسة أشخاص يعانون من AMD الجاف ، وهو الشكل الأكثر شيوعًا للحالة 13. هذه النتائج الأولية مليئة بالوعود. يقول همايون: "لقد أدى هذا إلى الكثير من الإثارة". لكن النتائج تحتاج إلى تأكيد من خلال تجارب المرحلة الثالثة في عدد أكبر من المشاركين ، ويحذر همايون من أن العلاج قد يكون بعيدًا عن الاستخدام لسنوات عديدة في العيادة ، لأنه لم يتم حتى الآن إكمال العلاج بالخلايا الجذعية لاضطراب الشبكية. عملية الموافقة.
يمكن لنهج ذي صلة ، لا يزال في المراحل الأولى من البحث الأساسي ، أن يفي بالأمل في استبدال الخلايا العصبية المفقودة ، ويفتح الباب أمام علاجات لمجموعة متنوعة من أمراض العيون. في البشر ، لا تنقسم الخلايا العصبية الناضجة وبالتالي لا يمكن أن تتجدد ، مما يجعل استعادة الرؤية أمرًا صعبًا بشكل خاص. لكن الشيء نفسه لا ينطبق على جميع الحيوانات. يمكن للزواحف وأنواع معينة من الأسماك تجديد الخلايا العصبية في شبكية العين ، كما تظهر الطيور أيضًا بعض القدرة على التجدد. يحاول توماس ريه ، عالم الأعصاب بجامعة واشنطن في سياتل ، إطلاق العنان لهذه القدرة لدى البشر. ولكن بدلاً من زرع الخلايا التي نمت في المختبر ، يهدف ريه إلى إقناع الخلايا الموجودة بالفعل في شبكية العين للتمايز إلى خلايا عصبية جديدة.
في عام 2001 ، اقترح ريه أن Müller glia - الخلايا التي توفر بنية لشبكية العين وتدعم وظيفتها - هي مصدر الخلايا العصبية الجديدة التي لوحظت في الأسماك والطيور. ثم شرع هو وفريقه في اكتشاف ما إذا كان من الممكن استخدام مولر الدبقية لتوليد خلايا عصبية جديدة في الفئران. في عام 2015 ، صمموا الفئران لصنع Ascl1 ، وهو بروتين مهم لإنتاج الخلايا العصبية في الأسماك ، ثم أتلف شبكية العين للحيوانات. كان أملهم أن يحرض Ascl1 مولر الدبقية على التحول إلى خلايا عصبية.
فشلت التجربة في إنتاج خلايا عصبية جديدة في الفئران البالغة ، لكنها نجحت في الفئران الصغيرة. اقترح نيكولاس جورستاد ، عالم الكيمياء الحيوية وطالب الدكتوراه في فريق ريس ، أن التعديلات الكيميائية التي يتم إجراؤها على الكروماتين (مركب من الحمض النووي والحمض النووي الريبي والبروتينات) في نواة الخلية أثناء التطور قد تمنع وصول الخلايا الناضجة إلى الجينات التي تمكن مولر الدبقية من التحول في الخلايا العصبية. في أغسطس 2017 ، أظهر فريق ريه أنه من خلال إدخال إنزيم يعكس مثل هذه التعديلات ، يمكنهم إقناع مولر الدبقية بالتفاضل. يقول ريه: "لأول مرة ، يمكننا تجديد الخلايا العصبية في فأر بالغ". "بعد كل هذه السنوات شعرت بسعادة غامرة." على الرغم من أنها لم تكن خلايا مستقبلات ضوئية حقيقية ، وبدت أكثر شبهاً بالخلايا ثنائية القطب ، إلا أن الخلايا العصبية المتصلة بالدوائر الموجودة ، وكانت حساسة للضوء. يقول ريه: "لقد فوجئت بأنهم يتواصلون جيدًا كما يفعلون
على الرغم من كونه بعيدًا عن الاستعداد لعلاج اضطرابات الشبكية لدى الأشخاص ، إلا أن العمل ينطوي على إمكانات هائلة. ستكون الخطوة التالية هي تكرار الدراسات على الحيوانات ذات العيون الأكثر تشابهًا مع البشر. يعمل فريق ريه بالفعل مع مزارع خلايا شبكية من الرئيسيات غير البشرية. يحتاج الباحثون أيضًا إلى معرفة كيفية توجيه عملية التمايز لإنتاج أنواع خلايا معينة مثل العصي والأقماع. يقول ريه: "الآن لدينا أقدامنا في مجال صناعة الخلايا العصبية ، ستكون المخاريط رائعة".
إذا نجحت ، يمكن أن يكون النهج قابلاً للتطبيق على نطاق واسع. يتنبأ ريه قائلاً: "في النهاية ، ستكون هذه هي الطريقة التي سيتم بها علاج جميع أمراض العيون هذه". "إنه أمر منطقي. لا داعي للقلق بشأن إجراء عمليات الزرع بالشكل الصحيح. خلاياك في المكان الذي تحتاج إليه تمامًا ". يتم تشجيع همايون أيضًا من خلال العمل. يقول: "أبتهج لأي شخص لديه فكرة جديدة جيدة". "إنه وقت مبكر جدًا ، إنه خطر كبير ، لكن لا تقل أبدًا أبدًا. هذا ما تعلمته ".
https://www.nature.com/articles/d41586-019-01107-8
حشوات القرنية
واحدة من أكثر المشاكل شيوعًا التي تؤثر على الأشخاص مع تقدمهم في السن هي أن أجزاء معينة من العضو الذي يعمل بشكل جيد تبدأ في التآكل ، والعين لا تختلف.
بالنسبة للكثيرين منا ، تصبح العدسة ، وهي جزء من العين يسمح لنا بالتركيز على الأشياء القريبة والبعيدة ، أكثر هشاشة وصلابة ، مما يجعل من الصعب بشكل تدريجي التركيز على الأشياء القريبة منا. لهذه المشكلة كانت النظارات والعدسات التصحيحية الأخرى تفعل ما لم تعد القرنية تستطيعه ، لكن التطورات الحديثة تقدم حلاً جراحيًا. باستخدام الليزر لعمل شق صغير في العين ، يتم إدخال ترصيع القرنية ، وهو غرسة بحجم ممحاة قلم الرصاص ، في العين للمساعدة في تركيز الضوء القادم إلى العين ، وإصلاح المشكلات المتعلقة بفقدان البصر القريب.
عدسات نانو الماس للجلوكوما
يعتبر الجلوكوما أحد أكثر الأمراض شيوعًا التي يمكن أن تؤدي إلى العمى. لطالما كانت الأدوية متاحة لهذا المرض ، ولكن بسبب الآثار الجانبية والطبيعة البشرية الأساسية ، يمكن أن يواجه المرضى صعوبة في الالتزام بجدول الجرعات الذي يقدمه أطبائهم ، ومع ذلك يمكن أن تجعل العدسات اللاصقة الجديدة توصيل الأدوية اللازمة أمرًا بسيطًا وفعالًا. من خلال ربط عقار تيمولول ماليات - وهو دواء شائع لإدارة الجلوكوما - بأحجار الماس النانوية المضمنة في العدسات اللاصقة ، يمكن إعطاء الدواء تلقائيًا. وحيث تتفاعل دموع العين الطبيعية مع الماس النانوي ، يتم إطلاق التيمولول بمرور الوقت ، مما يؤدي إلى مرض. إن الحد من حدوث الآثار الجانبية التي يمكن أن تمنع المرضى من استخدام قطرات العين تيمولول سيمنع الضرر طويل المدى. حيث يمكن أن يتسبب الجلوكوما في تلف العصب البصري ويؤدي إلى فقدان البصر بشكل تدريجي.
https://interestingengineering.com/5-medical-innovations-that-may-help-cure-blindness